Muchas actividades en nuestra vida cotidiana se repiten periódicamente, por ejemplo: normalmente, estudiamos de lunes a viernes y, en ciertas escuelas, todos los viernes existe una comprobación del aprendizaje. De esa forma decimos que la verificación del aprendizaje se repite periódicamente, es decir, regularmente en función de un determinado parámetro. Cada intervalo de repetición, que en ese caso es una semana (o siete días), es denominado periodo.
Otro aspecto importante que vemos en nuestro día a día es la organización. Por ejemplo, es mucho más fácil encontrar un CD, si todos los CDs están organizados según el tipo de música.
Asimismo, los científicos han observado que los elementos químicos conocidos hasta el momento podrían ser organizados de tal manera que algunas de sus características se repitieran periódicamente. Eso era de extrema importancia, pues ayudaría al estudio de los elementos, es decir, sería más fácil prever sus propiedades, comportamientos y hasta cómo serían determinados elementos que no eran conocidos en la época.
Muchos fueron los intentos para encontrar una tabla periódica para organizar los elementos de tal manera que sus características se repitiesen periódicamente.
Como sabemos, la forma más coherente fue dada inicialmente por el químico ruso Dmitri Ivánovich Mendeléyev (1834-1907), por la cual las propiedades de los elementos eran consideradas funciones periódicas de las masas atómicas de los elementos.
Sin embargo, en 1913, el físico inglés Henry Gwyn Jeffreys Moseley demostró que las propiedades de los elementos varían periódicamente en función de los protones existentes en el núcleo de los átomos de los elementos (carga nuclear), que pasó a ser denominado Número Atómico (Z). Esa forma de organización constituyó las bases de la Tabla Periódica actual.
Sin embargo, ha habido muchos otros intentos que han ayudado en el progreso del conocimiento de la periodicidad de los elementos y que culminaron en la actual tabla periódica. A continuación, explicaremos tres de estas ideas:
1) Tríadas: propuesta por Johann Wolfgang Döbereiner (1780-1849), en 1817. Los elementos con propiedades similares, es decir, que reaccionaban de manera semejante con otros elementos eran organizados en grupos de tres:
| Tríadas o grupos naturales de Döbereiner | |||||
| Litio (Li) | Calcio (Ca) | Fósforo (P) | Azufre (S) | Cloro (Cl) | Hierro (Fe) |
| Sodio (Na) | Estroncio (Sr) | Arsénico (As) | Selenio (Se) | Bromo (Br) | Cobalto (Co) |
| Potasio (K) | Bario (Ba) | Antimonio (Sb) | Telurio (Te) | Yodo (I) | Níquel (Ni) |
Observemos cómo estos grupos naturales aparecen en la tabla periódica actual:
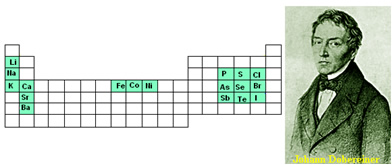
Grupos de tríadas de Döbereiner
La ley de tríadas propuestas por Johann Döbereiner está en armonía con la ley periódica de la tabla actual.
2) Tornillo telúrico: creado en 1862 por Alexandre-Emile Béguyer de Chancourtois (1820-1886). Los elementos se agruparon de forma ascendente en masa atómica en formato de un tornillo, es decir, en la forma de una espiral de 45° donde había 16 elementos en cada vuelta. Los elementos con características semejantes quedaban uno debajo del otro.
Por ejemplo, debajo se exhibe el Boro (B) alineado con el Aluminio (Al) y hoy esos dos elementos pertenecen a la misma familia (familia 3 o III A) de la Tabla Periódica.
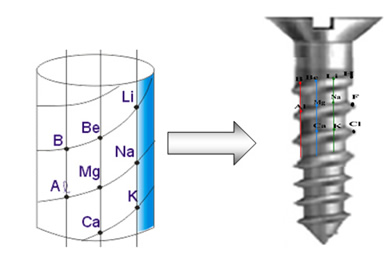
Tornillo telúrico de Chancourtois
3) Ley de las Octavas: fue propuesta por John Alexander Reina Newlands (1837-1898), en 1864. Puso los elementos agrupados de siete en siete, en orden creciente de masa atómica y señaló que el primer elemento tiene propiedades similares al octavo y así sucesivamente. Llamó a la ley de octavas, porque las características se repetían de siete en siete, como las notas musicales.
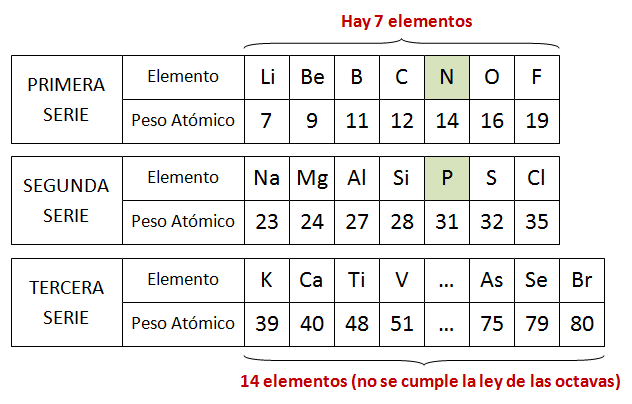
Ley de las Octavas propuesta por Newlands