 Es probable que en las clases de ciencias de la enseñanza fundamental hayas conocido ya los tres estados físicos básicos de la materia –el sólido, el líquido y el gaseoso.
Es probable que en las clases de ciencias de la enseñanza fundamental hayas conocido ya los tres estados físicos básicos de la materia –el sólido, el líquido y el gaseoso.
Estos estados vienen del estado de agregación física de las moléculas constituyentes de la materia. Si están estrechamente vinculadas y con una limitada libertad de movimiento limitada a apenas algunas agitaciones en torno de un punto de equilibro, tenemos en esa situación el estado sólido de la materia.
Con grado de libertad de movimiento mayor, pero con algunas restricciones, porque todavía hay fuerzas entre las moléculas, tenemos el líquido y con un grado aún mayor de libertad, ya que las fuerzas entre las moléculas son prácticamente despreciables, tenemos un estado gaseoso.
Una sustancia puede estar presente en cualquiera de estos estados dependiendo de las condiciones físicas de la temperatura y la presión a la que está sometido. Una forma muy común de cambiar el estado físico de una sustancia es por calentamiento, o por intercambio de calor con alguna fuente térmica.
Vamos a estudiar los procesos de cambio en el estado físico, así como las leyes que rigen tales fenómenos.
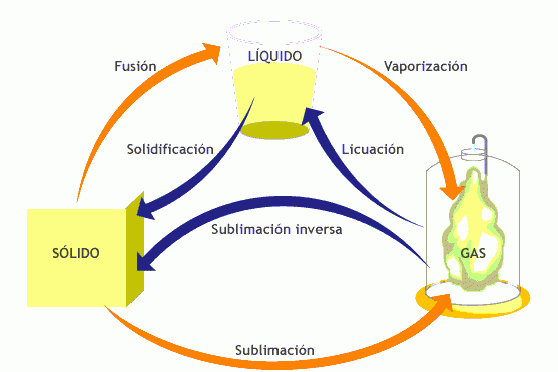
Fusión y solidificación
Cuando una sustancia se encuentra en estado sólido y es receptora de calor, su temperatura aumenta, y el estado de agitación de sus moléculas se incrementa. Si continuamos con este calentamiento, la agitación molecular se vuelve tan intensa que los enlaces entre las moléculas se rompen.
A partir de entonces, la energía que se transfiere en forma de calor ya no se utiliza para aumentar la agitación molecular, pero, para la ruptura de los enlaces moleculares. Estos enlaces se rompen moleculares en las moléculas de dar mayor libertad de movimiento, la caracterización de la fusión o de transición al estado líquido.
Solidificación
El proceso de solidificación es contrario a la fusión. Cabe mencionar que una sustancia en estado líquido está cediendo calor. Al ceder calor, su temperatura disminuye, así como el estado de movimiento de las moléculas. Esa disminución del movimiento molecular hará que las conexiones moleculares se vuelvan más intensas, caracterizando el estado sólido.
Vaporización
Si la sustancia con el elemento anterior sigue en estado líquido y continuamos ofreciendo calor, su temperatura irá en aumento. Con eso, habrá un aumento en el grado del movimiento de las moléculas.
En cierta temperatura, estas moléculas tienen energía suficiente para escapar de las fuerzas moleculares que todavía existen entre ellas y lograr un mayor grado de libertad. En este estado nuevo, conocido como gaseoso, las fuerzas entre las moléculas son prácticamente insignificantes.
La vaporización puede ocurrir en tres formas: evaporación, ebullición y calefacción.
Evaporación: este proceso ocurre de manera muy lenta a temperatura ambiente. Puede tomarse como ejemplo de referencia la evaporación del agua de la ropa en el tendedero.
Ebullición: este es un proceso más rápido que se produce a una temperatura fija. Este proceso se observa fácilmente al poner el agua a hervir.
Calefacción: es el proceso más rápido y se produce cuando la fuente de calor está a una temperatura mucho más alta que la temperatura de ebullición de la sustancia. Tomemos, por ejemplo una gota de agua sobre una placa metálica caliente.
Condensación
La condensación es el proceso inverso de vaporización. Al bajar la temperatura del gas, él empieza a perder su capacidad de potencia. Por lo tanto, las moléculas se unen a través de las fuerzas moleculares, de modo que la sustancia entra en el estado líquido.
Sublimación
El paso directo del estado sólido al estado gaseoso sin pasar por el líquido es definido como sublimación. Tal proceso solamente ocurre en condiciones adecuadas de presión y temperatura.
Las leyes generales del cambio de estado
Primera ley: durante el cambio de estado si la sustancia está a presión constante, la temperatura de cambio de estado permanecerá constante.
Este fenómeno se puede explicar por el hecho de que, en el cambio de estado físico, por ejemplo por calentamiento, la energía que es absorbida por la sustancia en forma de calor no está siendo usada para el aumento de la agitación molecular sino para romper los vínculos entre las moléculas.
Tomando nota de la declaración de la primera ley tenemos algo importante a analizar. La temperatura se mantiene constante si la presión permanece constante. A partir de ese momento, se puede concluir que, si cambiamos la presión, también cambiará su temperatura de cambio de estado.
Segunda ley: si la presión sobre la sustancia variase, el cambio de temperatura de estado también puede variar.
Ejemplos
- Ejemplo de fusión: hielo derritiendo transformándose en agua.
- Ejemplo de vaporización: agua hirviendo transformándose en vapor.
- Ejemplo de condensación: destilación de bebidas.
- Ejemplo de solidificación: botella de agua en un congelador.