Tanto las pilas como las baterías son dispositivos capaces de transformar la energía química, que está contenida en los materiales que las componen, en energía eléctrica. Por medio de reacciones espontáneas de oxirreducción, en donde hay transferencia de electrones del material que sufre oxidación para el que sufre reducción (gana electrones), se obtiene una corriente eléctrica que queda almacenada en el dispositivo y que, posteriormente, es transmitida para el equipo o aparato que se pretende conectar.
Sin embargo, la diferencia principal entre estos dispositivos radica en el hecho de que las pilas, también llamadas células electroquímicas, tienen sólo dos electrodos (polos positivos y negativos) y un electrolito o puente salino; mientras, las baterías están formadas por varias pilas conectadas en paralelo o en serie.
Por ejemplo, el ácido de la batería está formado por un electrodo negativo o ánodo — que es básicamente una envoltura de zinc (metal que tiene una tendencia a donar electrones) — y un electrodo positivo o cátodo, que es el polo que recibe los electrones, consistente en una barra de carbón o grafito insertada en un tubo poroso que contiene carbón machacado y dióxido de manganeso, rodeado por una pasta húmeda, que es el electrolito, que, a su vez, consta de varias especies químicas, entre las cuales el NH4Cl (cloruro de amonio) es la principal. El electrolito es el medio físico, una solución que permite la conducción de carga eléctrica en el interior de la pila.
A continuación tenemos un esquema de este tipo de pila:
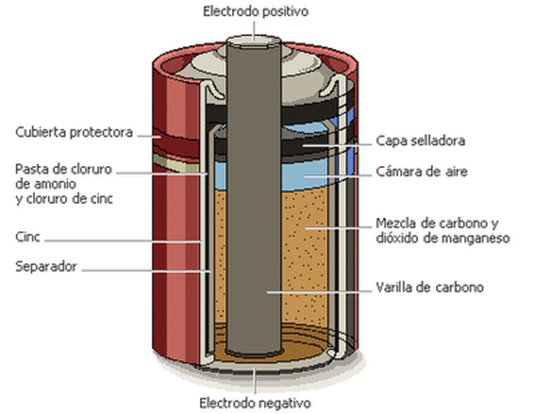
Esquema de pila ácida por dentro
El voltaje de las baterías depende de la diferencia de potencial entre los electrodos, es decir, el grado de espontaneidad con el que ocurre la transferencia de electrones de un electrodo para otro. Cuanto mayor sea la tendencia del ánodo de donar electrones y del cátodo de recibir electrones, mayor será la potencia de la pila.
Ahora hablando de las baterías, como se indica, están formados por varias células interconectadas entre sí. Cuando ellas están conectadas en paralelo, un polo positivo de una pila está unido al polo positivo de la otra, mientras el polo negativo está unido a otro polo negativo. Por otro lado, si las pilas que forman la batería estuvieran unidas en serie, tendremos un polo positivo unido a un polo negativo y así sucesivamente.
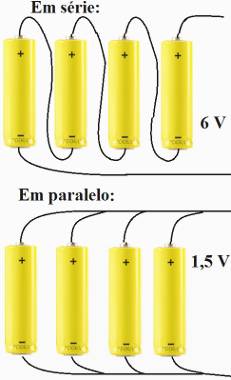
Esquema de formación de baterías unidas en serie y en paralelo
Como puede verse en la imagen superior, dependiendo de la forma en que están conectadas, las pilas pueden proporcionar diferentes voltajes y niveles de corriente. Una pila común generalmente posee un voltaje igual a 1,5 V, siendo que seis pilas unidas en serie originan una batería de 9 V.
Un ejemplo es la batería de plomo utilizada en los automóviles. Está formada por seis pilas de 2 V cada una, que poseen una potencia de 12 V en total. Está formado por varias placas de plomo, que son los electrodos negativos (ánodos que oxidan y pierden electrones). El cátodo o polo positivo que recibe los electrones es el dióxido de plomo. Todas esas placas quedan inmersas en una solución de ácido sulfúrico (H2SO4) y son intercaladas y separadas por cartón o plástico.

Imagen de batería por dentro y de las partes que la componen