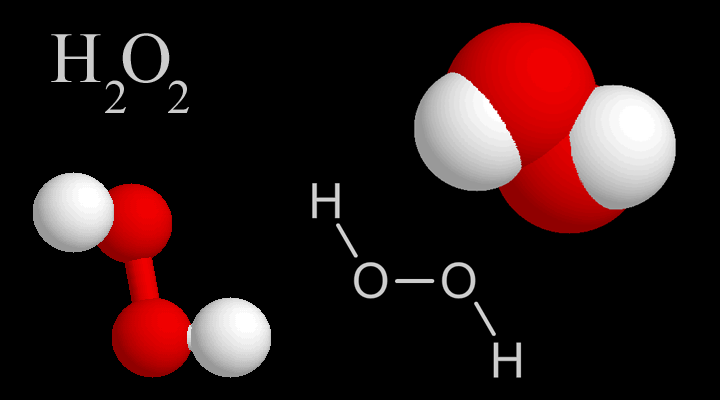
Fórmula del peróxido de hidrógeno
Los peróxidos son compuestos que presentan en su estructura el grupo (O2) 2- y que, al reaccionar con agua o con ácidos diluidos, producen peróxido de hidrógeno (H2O2).
Debido a este grupo (O2)2-, en los peróxidos el oxígeno presenta número de oxidación igual a -1 y no -2 como acostumbra a tener en la mayoría de compuestos.
El peróxido más conocido es el peróxido de hidrógeno donde la solución acuosa es denominada agua oxigenada. Él es comercializado con varias finalidades, entre ellas como decoloración del cabello, fibras textiles, papel, etc.
El peróxido de hidrógeno es un líquido incoloro, muy inestable, que se descompone solamente en presencia de luz, originando agua y gas oxígeno.
2 H2O2 → 2 H2O + O2
Los volúmenes expresados en los paquetes indican la proporción de la solución. Por ejemplo, 10 volúmenes indican que por cada litro de la solución se producen 10 litros de O2, en 1 atm y a 0 °C.
Sin embargo, el peróxido de hidrógeno no es el único peróxido existente, también hay peróxidos de metales alcalinos y de metales alcalinotérreos como es mostrado a continuación:
Peróxidos de metales alcalinos: son sólidos e iónicos y siempre cuentan con la siguiente fórmula: MA2O2, siendo que MA es el metal alcalino. Ejemplos: Li2O2, Na2O2, K2O2.
Peróxidos de metales alcalinotérreos: también son sólidos e iónicos y siempre presentan la siguiente fórmula: MATO2, siendo que MAT es el metal alcalinotérreo. Ejemplos: MgO2, CaO2, BaO2.
A continuación hay un ejemplo que muestra cómo un peróxido real en presencia de agua o de un ácido que agua oxigenada:
Peróxido + agua → base + agua oxigenada
K2O2 + 2 H2O → 2 KOH + H2O2
Peróxido + ácido → sal + agua oxigenada
K2O2 + 2 HCl → 2 KCl + H2O2