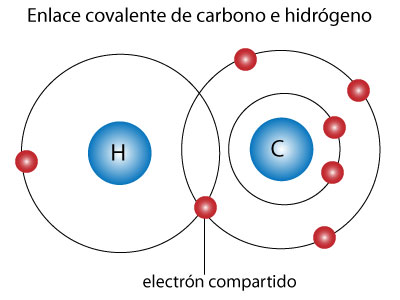
Compuestos covalentes, también llamados compuestos moleculares, son aquellos que poseen únicamente enlaces covalentes. Algunos ejemplos son:
Agua
H ─ O ─ H
Gas carbónico
O ═ C ═ O
Algunas características y propiedades de estos compuestos se explican a continuación:
Estados físicos: los compuestos covalentes pueden encontrarse en tres estados físicos a temperatura ambiente, como se muestra en la siguiente tabla. Sin embargo, debido a sus moléculas atraerse menos intensamente, los compuestos covalentes son, en general, gases o líquidos. También debemos tener en cuenta, en el contexto, que cuanto mayor sea la masa molar y más intensas las fuerzas intermoleculares, mayor será la tendencia para el compuesto a ser sólido a temperatura ambiente.
| Sustancia | Fórmula | Estado físico (a 25ºC y 1 atm) |
| Gas hidrógeno | H2 | Gaseoso |
| Sulfato de hidrógeno | H2S | Gaseoso |
| Agua | H2O | Líquido |
| Acetona | C3H6O | Líquido |
| Etanol | C2H5OH | Líquido |
| Sacarosa | C12H22O11 | Sólido |
Ejemplos de Estados físicos de algunos compuestos covalentes
Polaridad: Compuestos covalentes polares existen tanto polares como apolares. Lo que determinará su polaridad será la diferencia de electronegatividad entre los átomos implicados en enlace covalente. Si hay diferencia de electronegatividad, significa que el compuesto será polar; pero si no hay ninguna diferencia en la electronegatividad entre los átomos, no habrá ningún desplazamiento de carga en la molécula y ese compuesto será apolar.
Puntos de fusión y ebullición: por el hecho de presentar baja atracción entre sus moléculas, la energía necesaria para separarlas y hacerlas cambiar de estado de agregación es pequeña, por eso sus puntos de ebullición y de fusión son inferiores a los de las sustancias iónicas. Ese hecho también varía proporcionalmente con la masa molar las fuerzas de intermoleculares de los compuestos, es decir, con el aumento de la masa molar y de la intensidad de las fuerzas intermoleculares, los puntos de fusión y de ebullición aumentan y viceversa.
Conductividad eléctrica: en su forma pura, la mayoría de las sustancias covalentes no conduce corriente eléctrica, es decir, se comporta como aislante. Una excepción es el grafito, que conduce corriente eléctrica por poseer resonancia en los electrones de su doble enlace.
Solubilidad: la solubilidad de esos compuestos en agua y en otros solventes, como el alcohol y el queroseno, es bastante variada. Eso se da porque, conforme ya fue dicho, existen compuestos moleculares polares y apolares. De modo que los polares se disuelven en compuestos también polares y los apolares se disuelven en sustancias apolares, es decir, semejante disuelve en semejante.
Tenacidad (resistencia): dureza baja, siendo sólidos quebradizos.