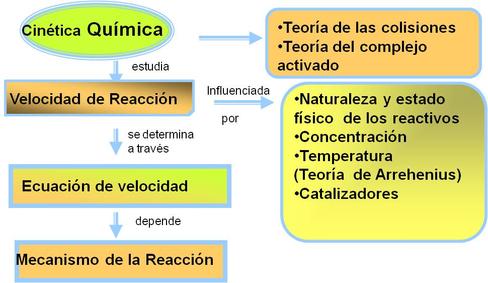
La cinética química estudia la velocidad de las reacciones químicas y los factores que la influencian.
El conocimiento y el estudio de la velocidad de las reacciones son muy importantes en términos industriales y también están relacionados con nuestra vida diaria, como por ejemplo, cuando ponemos comida en una olla a presión para acelerar la cocción.
Las reacciones químicas ocurren con diferentes velocidades y éstas pueden ser alteradas, porque además de la concentración de reactivos y productos, las velocidades de las reacciones también dependen de otros factores tales como:
Temperatura: al aumentar la temperatura de un sistema, sucede también un aumento en la velocidad de la reacción. Aumentar la temperatura significa aumentar la energía cinética de las moléculas.
Superficie de contacto: un aumento de superficie de contacto aumenta la velocidad de la reacción. Un ejemplo es cuando disolvemos un comprimido efervescente triturado: él se disuelve más rápidamente que si estuviera entero, esto ocurre porque aumentamos la superficie de contacto que reacciona con el agua.
Presión: cuando los participantes de una reacción son gaseosos y si aumenta la presión de ese sistema gaseoso, se aumenta la velocidad de la reacción. Eso porque el aumento de la presión disminuye el volumen, intensificando las colisiones de las moléculas.
Concentración de reactivos: cuanto mayor sea la concentración de los reactivos mayor será la velocidad de la reacción. Un ejemplo es cuando cogemos una muestra de lana y acero y reaccionan con el ácido clorhídrico concentrado y con ácido clorhídrico diluido.
Luz: Algunas reacciones químicas se procesan con mayor velocidad en presencia de luz, como por ejemplo, la descomposición del agua oxigenada. Por eso es que determinados productos son comercializados en frascos oscuros.
Catalizadores: los catalizadores son sustancias que aceleran el mecanismo sin ser consumidos durante la reacción. Este hecho es porque permiten que la reacción tome un camino alternativo, que exige menor energía de activación, haciendo que la reacción se procese más rápido. Un catalizador posee la propiedad de acelerar la reacción, pero no aumenta el rendimiento, es decir, él produce la misma cantidad de producto, sin embargo, en un periodo de tiempo menor.